ד”ר גל הרצוג
סניפירים- חוות גידול דגי נוי, גני טל.
08-9957774
[email protected]
הוגש לפרסום: 28/11/2020
דגים ויצורים מימיים אחרים, צורכים מזון ופולטים מגופם אל המים, בין היתר, חנקן בתצורת אמוניה* (NH3/ NH4+). אמוניה מהווה חומר רעיל ביותר לדגים, כבר מריכוז נמוך של 2 mg/L. בגופי מים בטבע, מתרחש תהליך ביוכימי המוכר כ-‘מחזור החנקן’. בתהליך, חיידקים אירוביים (צורכי אוויר), בעיקר אלה ממשפחת ה-Nitrosifyers, משתמשים באמוניה כתורם אלקטרונים ובחמצן כקולט אלקטרונים, לקבלת תוצר הנקרא ניטריט (NO2–). משפחת ה Nitrosifyers מונה מספר חברים (בניהם: Nitrosolobus, Nitrosovibrio, Nitrosococcus ו- Nitrosospira), אך זה המבצע את התהליך באקווריום הוא Nitrosomonas ובאופן ספציפי יותר, כפי הנראה Nitrosomonas marina [1].
חיידקים אירובים אחרים, המכונים Nitrifyers, משתמשים בניטריט כתורם אלקטרונים לצורך חימצונו לקבלת תוצר רעיל הרבה פחות, המכונה ניטראט (NO3–). ניטראט יכול לשמש כדשן לצמחים (לקריאה נוספת). ישנם מספר חיידקים Nitrifyers מוכרים, המבצעים את ההמרה, בניהם: Nitrococcus ו- Nitrospina. בעבר, זיהו בטעות את ה- Nitrobacter כקבוצת החיידקים האחראית על המרת הניטריט לניטראט באקווריום. בדיעבד התברר כי חיידקים מקבוצה ה Nitrospira הם האחראיים על התהליך [3]. בשל רעילותו הרבה של חנקן, חמצון שלו, חשוב ביותר לשמירה על אקווריום מאוזן. לכן, בכל התחלה של אקווריום חדש, או שיקום של אקווריום וותיק, חובה לבצע ‘סיקל’ (Aquarium cycling). תהליך זה, מתאר למעשה מצב בו באופן ייזום, אנו מייצרים, בקצב מתון, ריכוז הולך וגדל של אמוניה (באמצעות הכנסה גדלה והולכת של דגים או האכלה גוברת), ומעודדים חיידקים ניטריפיקנטים להתרבות מהר ככל הניתן. ריבוי החיידקים, מאפשר חמצון של כמויות גדלות של האמוניה לניטריט ולאחר מכן לניטראט, בתהליך המכונה ‘דה-טוקסיפיקציה’- הפחתת רעילות.
כיוון שתהליך ה’סייקל’ דורש זמן רב להשלמתו (כחודש- חודשיים), ישנם בשוק מספר רב של חברות האורזות בבקבוקוני נוזל, אותם הן מכנות ‘בקטריות חיוביות’. החברות, כל אחת לפי ראות עיניה, טוענת כי ארזה בבקבוק תמיסה המכילה מיקס של חיידקים ניטריפיקנטים, במצב רדום, חיי או כנבגים בתמיסה השומרת על חיוניותם לאורך זמן. עוד נטען, כי עם כניסתם למים, נכנסים אלה למצב פעיל ומסייעים לזרז באופן משמעותי את תהליך ה’סייקל’ ותוך כך לאכלס דגים באופן מהיר ובטוח בהרבה.
במאמר זה, נבדוק את אמינות הטענות, נעקוב אחר פעולתם של אותם חומרים וננסה לזהות אילו מהחומרים אפקטיבים עבור המגדל לביצוע תהליך סייקל מהיר, או בטיפול בהתפרצות חנקות באקווריום.
* כאן נתייחס לאמוניה כ TAN= Total Ammonia Nitrogen ולא נפריד את האמוניה לתצורת אמוניה/ אמוניום (לקריאה נוספת).
המים בהם השתמשנו בניסוי:
אקווריום בנפח L150 מולא ב 100 L מי ברז (TDS=320 ppm, pH=7.8- אידאלי לגדילת חיידקים[4]), אליו הוכנסה שקית של פחם Chemipure)) לספיחת שאריות כלור וכלוראמין הפוגעים בהתפתחות חיידקים. המים עורבלו באקווריום במשך שבוע באמצעות ראש כח בקצב של 950 L/H (Sicce) בנוכחות משאבת אוויר בקצב איורור של כ 100 L/H. לפני תחילת הניסוי, לא נמצאו במים נוכחות של אמוניה, ניטריט, ניטראט או כלור (ערכות בדיקה JBL).
תמיסת העבודה:
במיכלים בנפח משתנה (כמתואר בכל ניסוי) מולאו מי ניסוי והוסף נפח משתנה של תמיסת אמוניה כלוריד בריכוז 50 mg/L (Dr. Tim’s aquatic Ammonium Chloride Solution). התמיסה עורבלה ע”י ראש כח בקצב של 600 L/H במשך כשעה לקבלת תמיסה הומוגנית ונבדקה בערכת בדיקת אמוניה כללית (TAN).
ערכות בדיקה וחומרים:
לצורך בדיקה כמותית של אמוניה, השתמשנו בערכת בדיקת אמוניה של חברת JBL בתוספת בדיקה איכותנית של (Ammonia Alert) Seachem, ע”פ הוראות היצרן. במקומות בהם יחס הצבעים לא היה ברור לחלוטין, ביצענו מיהול 1:2 ו 1:5 של הדגימות, לקבלת ערך מדויק הנמצא בטווח הבדיקה.
כימות רמת הניטריט וניטראט בוצעה ע”י קיטים תואמים של חברת JBL, והתוצאות אומתו עם ערכת בדיקה מתאימה של חברת Seachem.
הבדיקות בוצעו בכל יום, בשעות הבוקר, באמצעות ערכות הבדיקה המתוארות ובהשוואה למפתח הצבעים של האינדיקטור בהן. הערכת הצבעים בוצעה באופן בלתי תלוי ע”י שני סוקרים שונים, כאשר לעולם האחד אינו מכיר את הסימון ע”ג המבחנות (Blinded test).
ניסוי 1:
1450 mL של תמיסת אמוניה בריכוז 2 mg/L, נמזגו למיכלי פלסטיק בנפח של 5 L. למיכל הוספו 100 g של קרמיקה המכילה סיבי זכוכית (PRODAC, Italy). לערבול המים באופן קבוע והכנסת אוויר, השתמשנו בראשי כח בקצב של 300L/H (Atman) אשר הונחו בתחתית כל מיכל. טמפ’ המיכלים נמדדה במשך הניסוי ונעה סביב טמפ’ החדר (25-28C). ההבדל בין המיכלים מתואר:

תמונה מייצגת של הצבת הכלים, קרמיקה וראשי הכח, כפי שבוצעה בניסוי מס 1′.
ניסוי 2:
900 mL של תמיסת אמוניה בריכוז של 1.5 mg/L נמזגו למיכלי פלסטיק בנפח של 1.2 L. למיכל הוכנסו 30 g של הקרמיקה שתוארה לעיל. לערבול ולאוורור המים באופן קבוע, הוכנסה אבן אוויר לכל מיכל והוזרם אוויר בקצב של כ 50 L/H ע”י משאבות אוויר (Newa). טמפ’ המיכלים משך הניסוי עמדה על 25-26C). ההבדל בין המיכלים השונים מתואר:
תוצאות
על מנת לקבוע את יעילות/ כמות הבקטריות הניטריפיקנטיות, מקובל לעקוב אחר שני מדדים מקבילים: שינוי ריכוז האמוניה והצטברות ניטריט. למעשה, ככל שאוכלוסיית החיידקים הניטריפיקנטים גדולה יותר, אמוניה הנוכחת במיכל תומר במהירות גבוהה יותר לניטריט, אשר יהפוך בהמשך לניטראט ובכך יבצע דה טוקסיפיקציה לחנקן. לכן, שמנו במיכלים ריכוז קבוע של אמוניה ועקבנו אחר קצב המרתה (ראה ניסוי מס’ 1 לעיל).
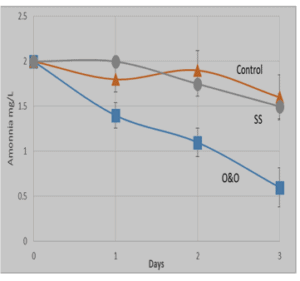
גרף 1: קצב ירידת ריכוז אמוניה כתלות בזמן (ביקורת- משולשים), כאשר הוספנו את הבקטריה החיונית One & Only (ריבועים) וכאשר הוספנו לתמיסה בקטריה של חברה אחרת SS (עיגולים). ניתן לראות הפחתה משמעותית של ריכוז האמוניה כאשר הוספנו לתמיסה בקטריה חיונית של One & Only. בארים מתארים סטיית תקן בין כל שלוש מדידות.
מהניסוי עולה (גרף 1), כי ישנה הפחתה קלה של ריכוז האמוניה במים, עם חלוף הזמן, ללא קשר לנוכחות ‘סקטריה חיונית’. כאשר הוספנו בקטריה המכונה (SS), הפחתת ריכוז האמוניה הייתה מינימלית ובסה”כ דומה למדי להפחתה בריכוזי האמוניה אשר התרחשה בביקורת שלנו. הוספה של 50 ml One & Only, הובילה להפחתה ניכרת של כ 60% מריכוז האמוניה בתוך פרק זמן של 3 ימים.
במקביל למעקב אחר הפחתת ריכוז האמוניה, בדקנו, באותן תמיסות, גם את ריכוז הניטריט (גרף 2). מצאנו כצפוי, כי ירידה ברמות האמוניה היו מלוות בעלייה בריכוז הניטריט בדוגמאות בהן הוסף החומר One & Only. עבור הביקורת והדוגמאות להם הוסף החומר SS, לא נראתה עליה משמעותית בריכוזי הניטריט.
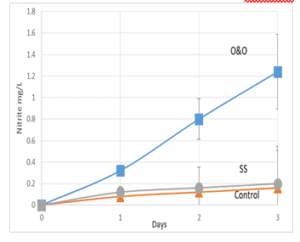
גרף 2: קצב עליית ריכוז ניטריט כתלות בזמן (ביקורת- משולשים), כאשר הוספנו את הבקטריה החיונית One & Only (ריבועים) וכאשר הוספנו לתמיסה בקטריה של חברה אחרת SS (עיגולים). ניתן לראות עליה משמעותית של רמות הניטריט בתמיסות המכילות בקטריה חיונית של One & Only. בארים מתארים סטיית תקן בין כל שלוש מדידות.
על מנת לאשר את מהימנות התוצאות, בחרנו להשתמש בערכת בדיקה נוספת של חברת Colombo למדידת רמות הניטריט שהתקבלו ביום השלישי לניסוי (תמונה 2- דוגמאות ביום האחרון לניסוי כפי שהופיעו בגרף מספר 2). לקחנו דוגמאות של 3 ml של שלוש החזרות של כל אחד מהטיפולים (ביקורת- ללא בקטריה מתוספת; תוספת בקטריה SS; תוספת בקטריה One & Only) והכנסנו אותן כמיקס לבקבוקון הבדיקה. הוספנו את נוזל האינדיקטור של Colombo, ע”פ הוראות היצרן.

תמונה 2:בדיקה של רמות ניטריט ביום השלישי. איחוד דוגמאות של בדיקות זהות (Pool) שנדגמו ביום השלישי לניסוי. שימוש בערכת Colombo, ספציפית למדידת רמת ניטריט. Control– מייצגת את דוגמאות הביקורת 1-3; SS מייצג את התמיסות שבהן תיספנו ב בקטריה SS (4-6); One & Only– מייצג את איחוד תמיסות 7-9 אשר בהן הוספנו בקטריה חיונית מסוג One & Only. צבע הנוטה יותר לאדום, מעיד על ריכוז ניטריט גבוה יותר.
כפי שעולה מהתוצאות (תמונה 2), גם שימוש בערכת מדידת ריכוז ניטריט של חברת Colombo, מציגה צבע חזק יותר של אינדיקטור בתמיסות שהוספו להן בקטריות
One & Only, עובדה המעידה על ריכוז גבוה יותר של ניטריט בדוגמאות אלה.
על מנת לבדוק, אם ישנם הבדלים נוספים בין הדוגמאות, כדוגמת רמת pH, קשיות מים וכו’, השתמשנו בערכות הבדיקה של JBL 6 in 1 הבודקת ריכוז של 6 ערכים חשובים באקווריום: ניטירט (NO2), ניטראט (NO3), חומציות (pH), קשיות זמנית (KH), קשיות קבועה (GH) וכלור (Cl2) (תמונה 3).

תמונה 3: מתארת בדיקה של 6 ערכים כימיים מקובלים למי אקווריום. מקלונים 1-3 משקפים את הערכים של דוגמאות הביקורת; מקלונים 4-6 מתארים את הערכים שנמדדו במיכלי ה SS ומקלונים 6-9 מתארים את הערכים שנמדדו עבור תמיסות שהוסף להם One & Only. ערכי המים דומים מאוד בין הדוגמאות השונות, מלבד ערכי הניטראט (מסומן בתבנית אדומה) בעוד הניטריט נמצא מיד מתחתיו. ניתן לראות כי ערכי הניטראט גבוהים בהרבה עבור דוגמאות שהוסף להם One & Only.
כיוון שקיים מגוון גדול של חברות המייצרות בקטריות חיוניות, בחרנו להרחיב את הבדיקות שלנו, גם לחברות נוספות. באופן דומה, כמתואר עבור ניסוי 1 (ראה שיטת עבודה), עקבנו אחר הצטברות ניטריט במבחנות השונות, כאינדיקציה ליעילות הבקטריות החיוניות אשר הוספו לדוגמאות (גרף 3).
בניתוח התוצאות, נראה כי כלל הבקטריות שנבדקו, לא שיפרו במאום את הקצב הטבעי של עליית ריכוז הניטריט באקווריום. זאת לעומת הוספת החומר One & Only, אשר זירז באופן ניכר (עד כמעט פי 10 ביום הראשון לניסוי) את הצטברות הניטריט בחלוף הזמן.
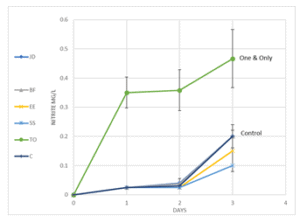
גרף 3: קצב עליית ריכוז ניטריט כתלות בזמן. הוספה של בקטריות חיוניות של מגוון יצרנים (JD, BF, EE, SS) לא הובילה לעליה בקצב ייצור הניטריט. תוספת של One & Only (TO) לתמיסה הובילה לעלייה משמעותית בריכוז הניטריט בתמיסה. בארים מתארים סטיית תקן בין כל שלוש מדידות.
מתוך חשש כי ראשי הכח, בהם השתמשנו בניסוי הקודם, יוצרים טורבולציה חזקה, הפוגעת בפעילות החיידקים, החלטנו לבצע ניסוי נוסף, בו השתמשנו במשאבות אוויר, לצורך ערבול עדין ויצירת הומוגנציה בתמיסה (ראה שיטות עבודה, ניסוי 2). גם כאן (גרף 4), ניתן לראות בבירור, כי כלל החומרים שנבדקו, לא הובילו לשינוי משמעותי בקצב צבירת הניטריט, זאת לעומת One & Only, אשר זירז כבר ביום השני לניסוי את קצב הסיקל הביולוגי, פי 2 לערך. בנוסף, ראינו כי המגמה נשמרת לאורך כל זמן המעקב (שהפעם נמשך 6 ימים).
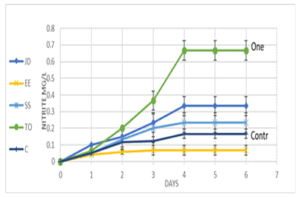
גרף 4: קצב עליית ריכוז ניטריט כתלות בזמן. הוספה של בקטריות חיוניות של מגוון יצרנים (JD, BF, EE, SS) לא הובילה לעליה בקצב ייצור הניטריט. תוספת של One & Only (TO) לתמיסה הובילה לעלייה משמעותית בריכוז הניטריט בתמיסה. בארים מתארים סטיית תקן בין כל שלוש מדידות.
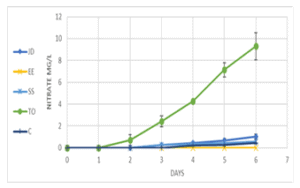
גרף 5: קצב עליית ריכוז ניטראט כתלות בזמן. הוספה של בקטריות חיוניות של מגוון יצרנים (JD, BF, EE, SS) לא הובילה להצטברות נמוכה של ריכוז הניטראט. תוספת של One & Only (TO) לתמיסה הובילה לעלייה משמעותית בריכוז הניטראט בתמיסה. בארים מתארים סטיית תקן בין כל שלוש מדידות.
כדי להשלים את התמונה, לקחנו את אותן הדוגמאות שתוארו בניסוי הקודם, ובדקנו את רמת הניטראט בהן (השלב הסופי והפחות טוקסי במעגל החנקן) (גרף 5). ניתן לראות בבירור כי רמות הניטרארט, הגבוהות ביותר תועדו עבור הדוגמאות בהן הוספנו את נוזל הבקטריה One & Only (TO) (מעל לפי 7 בהשוואה לביקורת) . למעשה, נראה כי הוספת שאר נוזלי הבקטריה שנבדקו, לא תרמו להצטברות ניטראט בתמיסה.

תמונה 4: מדידה של ריכוז הניטראט ביום ה-6 לניסוי. תמונה מייצגת של סיום הניסוי המתואר בגרף 5. עוצמת הצבע במבחנה מעידה על ריכוז הניטראט. ככל שצבע האינדיקטור כהה יותר- ריכוז הניטראט במבחנה גבוה יותר.
מסקנות
ירידה קלה בריכוזי אמוניה, גם ללא הוספת ‘בקטריה חיונית’
אמוניה היא מהחומרים הרעילים ביותר המצויים באקווריום ובבריכת הנוי. הצטברות אמוניה נובעת משבירת שיווי המשקל בין קצב היצירה של אמוניה (הכנסת דגים בקצב מהיר למיכל/ האכלות יתר וכו’) לבין פירוקה (אוכלוסיית חיידקים ניטריפיקנטים קטנה מדי/ עיכוב בפעילות החיידקים/ תמותת חיידקים). כל הטיה של שווי המשקל לצד יצירה מוגברת או עיכוב הפירוק, יוביל בהכרח להצטברות אמוניה במיכל. כיוון שכך, ישנה חשיבות גבוהה מאוד לשימוש בתכשירים המכונים ‘בקטריות חיוניות’ יעילים, אשר יזרזו באופן משמעותי או ימירו את חנקת האמוניה לחנקה שאינה רעילה, כדוגמת ניטראט.
בניסוים המתוארים, עקבנו אחר קצבי פירוק האמוניה, בנוכחות ובהעדר אותם תכשירי ‘בקטריה חיונית’ המצויים כיום בשוק.
השפעה של תכשירי ‘בקטריה חיונית’ על הפחתת ריכוז האמוניה
לאורך כלל הניסויים, זיהינו הפחתה משמעותית של ריכוזי האמוניה ההתחלתיים, כאשר במיכלים נכח החומר One & Only. למעשה, שיעורי ההפחתה נעו בין 60-80% (בהשוואה לביקורת) כבר ביום השלישי. שיעורי שכאלה, בהחלט מעידים על זירוז משמעותי של המרת אמוניה וביצוע תהליך ‘סייקל ביולוגי’ מהיר במיוחד.
בניגוד למצוין בספרות [1] בכלל הניסויים שלנו (גרף 1 מייצג), קיבלנו ירידה קלה של ריכוזי אמוניה בחלוף הזמן, גם ללא תיסוף ב’בקטריה חיונית’. כפי הנראה, הסיבה להבדל הוא שאנו, בניגוד לאחרים, עבדנו לאורך כלל הניסויים עם כלי הניסוי פתוחים, על מנת לדמות ככל הניתן, את המתרחש באקווריום ובבריכת הנוי, החשופים כל העת לאוויר אטמוספרי. אנו משערים כי ירידה קלה בריכוז האמוניה בניסויים המתוארים, נובעת מתופעת ה- off gassing (יציאת גז מהתמיסה) בעיקרה.
תמונה 3, מראה כי נוכחות התכשירים השונים בתמיסה, אינה משפיעה על ערכים חשובים אחרים במים כמו: חומציות pH, קשיות המים GH ורמת החציצה KH. נזכיר כי שינויים משמעותיים מאוד של ריכוזי חנקות יכולים בהחלט להוביל לשינוי בחומציות המים, אך נראה כי בטווח הניסויים שתוארו, אין זה כך.
השפעה של תכשירי ‘בקטריה חיונית’ על עליית ריכוז הניטריט
מעקב אחר ריכוז הניטריט במים, הינו מדד מהיימן עבור פעילות בקטריאלית חיובית באקווריום. למעשה, ירידת ריכוז הניטריט ל-0, הוא הקובע כי תהליך הסייקל הסתיים.
במאמר זה, בוצעו מגוון סוגי ניסויים, המדמים ככל הניתן את התהליכים המבוצעים באקווריום ובבריכת הנוי.
גרפים 2,3 ו-4, העוקבים אחר קצב הצטברות הניטריט, עומדים בהלימה גבוהה לתוצאות שראינו בכל הנוגע להפחתת ריכוזי האמוניה. המוצר הבולט בהקשר זה, הוא ה One & Only אשר הציג קצב גבוה עד פי 7 בהאצת תהליך הסייקל. חומרים אחרים שנבדקו, לא הובילו לשינוי משמעותי בקצב הצטברות הניטריט, בדומה לתוצאות שהתקבלו עבור מעקב פירוק האמוניה (גרף 1 כמייצג).
השפעה של תכשירי ‘בקטריה חיונית’ על הצטברות הניטראט
ניטראט הוא התוצר האחרון במחזור החנקן. אקווריום יציב, או אקווריום שעבר ‘סיקל’ תקין הוא, אקווריום בו החנקה היחידה המצטברת (בריכוזים של עד כ- 100 mg/L) היא הניטראט. לכן, החלטנו לעקוב מי מהתכשירים מוביל להצטברות של התוצר הסופי. בהתאמה רבה לתוצאות אשר הצגנו עבור פירוק אמוניה והצטברות ניטריט, ניתן לראות בבירור כי השפעתו של החומר One & Only, עדיפה בהרבה, בהשוואה לכלל החומרים שנבדקו. למעשה, גם כאן נראה כי ישנו זרוז של קצב יצירת הניטראט בשיעור של פי 7, לעומת הביקורת.
אך, כיצד יתכן כי כמות החנקה שהוכנסה בתחילה (אמוניה) עומדת על 2 mg/L לעומת כמות החנקה הסופית שנמדדה (ניטראט) העומדת על 9 mg/L? כיצד ‘נכנסה’ למערכת חנקה נוספת?
אנו מניחים כי שתי סיבות הובילו לכך שנראה כין ריכוז הניטראט שנמצא, גבוה בהרבה מריכוז האמוניה (2mg/L) שהוספה בתחילת הניסוי:
סיבות אפשריות לחוסר השפעה של ‘בקטריה חיונית’ על מחזור החנקן באקווריום
חיידקים ניטריפיקנטים שייכים למשפחת ה Nitrobacteraceae. משפחת חיידקים זו, אינה יכולה לייצר מבנים של ספורה (נבג), אינה שורדת ללא מים (ייבוש), לא ניתן להקפיא אותה ויש לשמור אותה חייה בסביבה מאווררת. אם כן, כיצד מצליחות החברות לארוז ‘חיידקים חיוניים’ בבקבוק ועדיין לשמור על פעילותם? למעשה, לרב הם פשוט מכניסים לבקבוק חיידקים אחרים המכונים: heterotrophic “nitrifyers“. אומנם בקבוצת חיידקים זאת, ישנם חברים המסוגלים לבצע חמצון של אמוניה לניטריט, אך ביעילות נמוכה מאוד (ביעילות נמוכה פי 1,000- 1,000,000 מחיידקים ניטריפיקנטים). בנוסף, רב ההמרה מבוצעת מאמוניה לכדי חנקן חופשי המשתחרר מהמים ואינו הופך לניטריט. באופן כללי, חיידקים אלה מעדיפים להשתמש בחנקן ממקור אורגני והם אינם מסוגלים להמיר ניטריט לניטראט בכלל. לאור זאת, ברור לחלוטין כי התרומה היחסית של מוצרי ה’בקטריה החיונית’ לסייקל הביולוגי, צפוייה להיות מראש נמוכה מאוד. לצערנו, מרבית החברות, מסיבות ברורות של קניין רוחני, אינן מפרטות את הרכב החיידקים בתכשיר או את אופן שימורם. בהעדר מידע שכזה, לא ניתן להעריך את אופן הפעולה שלהם באקווריום ובבריכת הנוי.
תכשירי ‘בקטריה חיונית’ שכן עובדים
מתוך רצון לזהות תכשירים מצטיינים, ניסינו ככל האפשר לדמות את מערכי הניסויים שלנו לתנאים המתרחשים באקווריום ובבריכת נוי פעילה. כך עבדנו עם מיכלים בנפחים שונים, שיטות איוורור וטורבולציה שונות ומגוון ערכות בדיקה. התוצאות שלנו, מזהות באופן ברור כי התכשיר המשווק כ One & Only של חברת Dr. Tim’s aquatics, מציג תוצאות עדיפות בכל הפרמטרים הנבדקים: הפחתת כמות האמוניה, הצטברות של ניטריט והחשוב ביותר, הצטברות ניטראט כחומר סופי ופחות רעיל.
חשוב לציין, כי מעקב אחר פעילות החיידקים לאורך מספר ימים, כמו שבוצע בעבודה זאת, היא אומנם מדד חשוב במיוחד, אך חשוב לוודא יציבותם לאורך זמן במיכל עצמו. מבדיקות שביצעו עמיתים, לדוגמה, נמצא כי מוצר המשתמש בשילוב של בקטריות מסוגNitrosomonas europaea (כממירות את האמוניה לניטריט), בשילוב עם בקטריות מסוג Nitrobacter winogradskyii (ניטריט לניטראט), אומנם מוביל להמרה מהירה של אמוניה לניטראט במעבדה, אך כאשר משתמשים בחומר באקווריום, לאחר מספר שבועות הבקטריות אינן נשארות יציבות, ולכן התהליך כולו נכשל. אמוניה מצטברת מחדש, בריכוזים גבוהים מאוד, ומסכנת את כל המיכל.
בתכשיר של Dr. Tim ישנו שימוש בבקטריות המבודדות שנמצאו היעילות ביותר בתהליך: Nitrosomonas ו- Nitrospira, אשר נשמרות במצב חיי בתוך הבקבוק. נראה שזוהי התצורה המאפשרת בהחלט זירוז של תהליך הסייקל באקווריום.
נספח 1: 
מקורות מידע:
המוצרים באתר נשלחים בדואר רגיל (10-14 ימי עסקים- עלות של 20 ₪), או בדואר מהיר עד הבית בימי שני ושלישי בלבד (עד 5 ימי עסקים בעלות של 50 ₪יתכנו עיכובים ליישובים מרוחקים ). * הזמנת צמחי מים באתר מתאפשרת בדואר מהיר, או באיסוף בחווה בלבד. * בהזמנה של 400 ש”ח ומעלה של צמחי מים, המשלוח ללא תוספת עלות. * המשלוחים מתבצעים לכל חלקי הארץ – עד לבית הלקוח. * ניתן לבצע איסוף מחוות סנפירים- בתאום מראש. * ט.ל.ח.
© כל הזכויות שמורות לסנפירים חוות גידול דגי נוי
הקמת אתר מכירות ע”י יולי פיתוח וקידום אתרים
