אמוניה- הרוצח השקט!
ד”ר גל הרצוג1
1סניפירים- חוות גידול דגי נוי, קיבוץ חפץ חיים. 050-5966801 [email protected]
הוגש לפרסום: 11/04/15
מבוא
דגים, כמו כלל היצורים החיים, צורכים מזון על מנת לספק את האנרגיה הדרושה להישרדותם, ואת אבני הבניין המשמשות לגדילתם. תוצר הלוואי העיקרי המתקבל כתוצאה מפירוק ושימוש במזון זה הינו האמוניה , אותה מפריש הדג כפסולת ממבראנת הזימים, בשתן ובצואה [1].
מתוך כלל המדדים הקובעים את איכות המים, לריכוזי האמוניה חשיבות גבוהה ביותר והיא שנייה רק לריכוז החמצן המומס. ריכוזים עולים של אמוניה, עשויים לגרום לעקה בדג, פגיעה בזימים ואף לתמותה. למעשה, אפילו חשיפה ממושכת של דגים לריכוז אמוניה נמוך, מורידה באופן משמעותי את יכולת הדג להתנגד למחלות ומעכבת את גדילתו [2]. השילוב של רעילות גבוהה מאוד עם העובדה שאמוניה היא חומר חסר ריח או צבע, הופכת אותה ל”רוצח שקט” של דגים.
שתי תצורות של אמוניה:
מקובל להתייחס לריכוז האמוניה במים כמדד יחיד המכונה “סך כלל האמוניה” (Total Ammonia Nitrogen= TAN) והוא הערך המתקבל בערכות הבדיקה הסטנדרטיות. למעשה מדד זה, מקורו בשתי תצורות שונות של אמוניה, האחת, +NH4 המכונה גם אמוניה מיוננת או אמוניום (Ionized Ammonia) והיא בעלת מטען חיובי, והאחרת NH3 המכונה גם אמוניה שאינה מיוננת (Unionized Ammonia=UIA) ומטענה ניטראלי [3]. היחס בין האמוניה המיוננת לבין האמוניה שאינה מיוננת נקבע ע”י טמפרטורה ורמת החומציות של המים (pH) (טבלה 1). באופן כללי, ככול שהטמפרטורה ו/או רמת ה- pH גבוהות יותר, החלק היחסי של אמוניה בלתי מיוננת גבוה יותר, כאשר ל- pH השפעה ניכרת בהרבה מזו של הטמפרטורה.
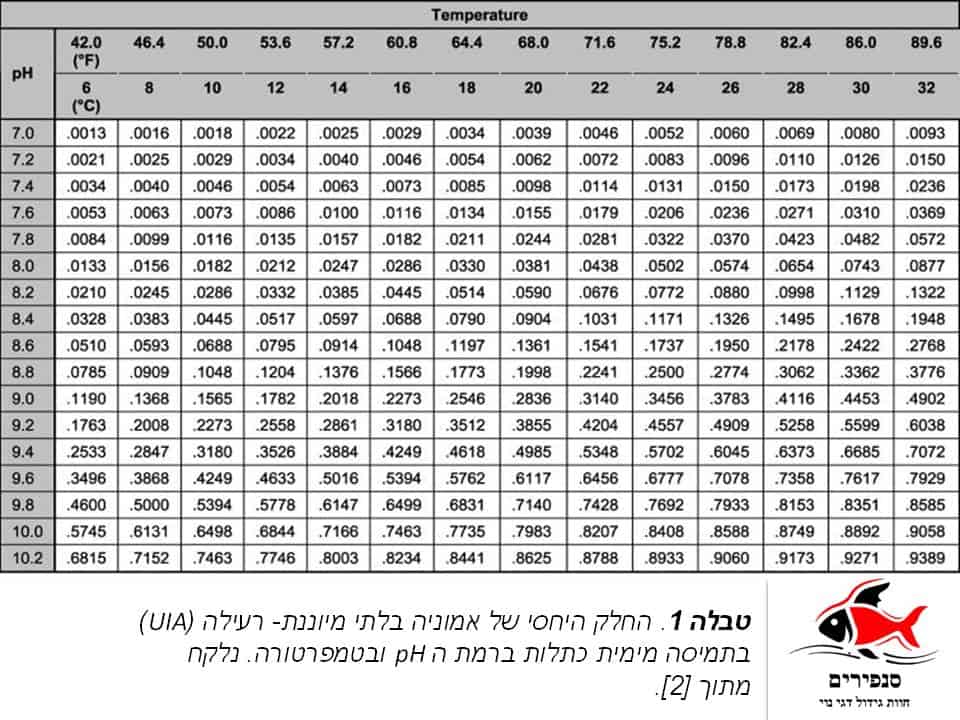
ההבחנה בין סוגי האמוניה השונים חשובה במיוחד עבורנו. אמוניה בלתי מיוננת (UIA), היא גז המומס במים ולכן יכולה לעבור בקלות דרך ממברנת הזימים של הדג. לעומתה, אמוניה מיוננת, הנה תורם פרוטונים אשר רק בריכוזים גבוהים יכול לגרום לכוויות בדג. נקבע כי אמוניה שאינה מיוננת (UIA) רעילה עבור הדג פי מאה מהאמוניה המיוננת [3]. מכך ניתן להבין כי עלייה בטמפרטורה או ברמת ה pH גורמים לעליה באחוז האמוניה המסוכנת יותר (UIA) מתוך ריכוז האמוניה הכללי במים ותוך כך לסיכון הדגים.
מחזור החנקן במערכות מימיות
בשל מסוכנתה של האמוניה עבור יצורים ימיים, התפתח במהלך האבולוציה, תהליך המכונה “מחזור החנקן” ותפקידו להמיר אמוניה לתוצר בלתי רעיל. התהליך מבוסס בעיקרו על שתי קבוצות חיידקים ומסתייע בצמחים לקליטת התוצר הסופי (תמונה 1). בשלב הראשון, מומרת האמוניה לניטריט (NO2-). ההמרה מבוצעת ע”י קבוצת חיידקים המכונה ניטרוסומונס (Nitrosomonas) אשר מחמצנת את האמוניה ובכך מפחיתה את רעילותה. בשלב הבא, קבוצת חיידקים המכונה ניטרובקטר (Nitrobacter), מחמצנת את הניטריט לקבלת תוצר שאינו רעיל (אלא ברמות גבוהות) בשם ניטראט (NO3-). נציין כי ניטראט נצרך ע”י צמחים ואצות ומשמש כדשן טבעי לגדילתם. כיוון שמדובר בתהליך בו מוספות מולקולות חמצן (תמונה 1), ברור שישנו צורך באוורור קבוע, שאם לא כן, יפגע תהליך ההמרה ורמות האמוניה והניטריט צפויות לעלות.
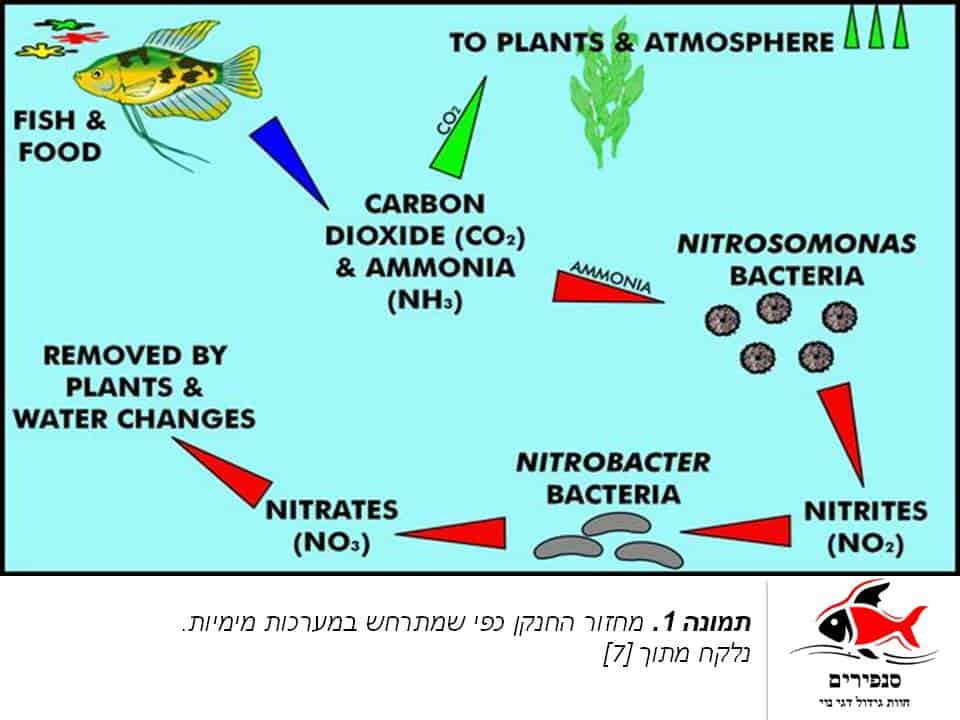
בבריכות טבעיות, מחזור החנקן מתרחש בעיקר בשכבה העליונה של בוצת הבריכה, בעוד בבריכות נוי ואקווריומים, מתרחש התהליך בעיקר בפילטר הייעודי, שם מתמקמות הבקטריות.
אמוניה בבריכות נוי
שאריות מזון, צואה, עלים וכו’ יוצרים בבריכת הנוי משקעים אורגנים המכונים בוצה. הבוצה עוברת תהליכי ריקבון טבעיים אשר משחררים אל המים בדיפוזיה גם כמות נכבדת של אמוניה [1]. למעשה, גם כאן למחזור החנקן ישנה חשיבות רבה בהמרה של אמוניה, אולם זהו אינו התהליך היחיד המוביל לסילוקה מהמים. בבריכה, אמוניה נספחת גם ע”י אצות וצמחי מים המשתמשים בה לגדילה. למעשה, ניתן לראות בתהליך הפוטוסינתזה מעין ספוג עבור אמוניה.
הוזכר כי ישנם מספר פרמטרים המשפיעים על ריכוז האמוניה הרעילה במים, בניהם: טמפרטורה, כמות חמצן מומס ורמת ה- pH. בניגוד לאקווריום, בריכת הנוי מושפעת מאוד ממזג האוויר ותוך כך לשינויים בטמפרטורה. אומנם עליה בטמפרטורת המים מובילה להעלאת ריכוז האמוניה הרעילה (ראה טבלה 1), אך מאידך מובילה גם לקצב מוגבר של גדילת אוכלוסיית החיידקים הניטרפיקנטים (Nitrosomonas ו- Nitrobacter, ראה תמונה 1) אשר ממירים אמוניה לתוצרים בלתי רעילים. כך, בחישוב נטו, טמפרטורות של עונות המעבר (אביב וסתיו) מסייעות בפירוק אמוניה בעוד אלה השוררות בארצנו בקיץ (ומובילות לרמות גבוהות של UIA) ובחורף (עיכוב גדילת החיידקים) פוגעות ביכולת זו.
גורם נוסף העשוי להוביל לשחרור אמוניה בבריכה הוא תמותה מסיבית של אצות (אם מסיבה מכוונת או מקרית) המעודדת תהליכי ריקבון. אומנם ריקבון מוביל להפחתת pH ותוך כך ליחס גבוה יותר של אמוניה שאינה רעילה (מיוננת), אך מאידך מוריד באופן משמעותי את כמות החמצן המומס במים ומעלה את רמת הפחמן הדו חמצני אשר מעכבים את יכולת החיידקים הניטריפיקנטים לחמצן אמוניה במעגל החנקן. בנוסף, ירידה בערכי ה-pH מובילה להגברת הרעילות של הניטריט בניגוד לאמוניה (ידובר במאמר המשך). כך, פגיעה באוכלוסיית האצות עשויה להוביל באופן עקיף גם לפגיעה בדגים.
בדיקת רמות האמוניה במים
ניתן לקשר פעמים רבות את תמות הדגים לרמות האמוניה במים לכן, מומלץ לנטרה באופן תדיר אחת לשבועיים. עם זאת, רב החובבים מבצעים בדיקה שכזאת רק במקרים הבאים: כאשר הדגים נראים רדומים או שוחים במצב אנכי בקרבת פני המים או ממש בצמוד לקרקעית (עבור דגים שאינם דגי קרקעית), זימי הדגים או עינייהם אדומים או דלקתיים, איבוד תאבון, מים עכורים (במיוחד לאחר שימוש בתרופות אנטיביוטיות) או במקרה של תמותה.
כיוון שאמוניה הינה חומר חסר ריח או צבע, יש להשתמש בערכות ייעודיות לקביעת ריכוזה. נזכיר כי כלל הבדיקות הללו מציינות את רמת כלל האמוניה (TAN) ולכן יש לבחון גם את טמפרטורת המים ואת חומציותם על מנת לקבוע את רמות האמוניה המסוכנת (הבלתי מיוננת=UIA) (טבלה 1).
באקווריומים ובריכות מאוזנים ביולוגית, לא צפויה להימצא אמוניה כלל (TAN=0). נוכחות מסוכנת של אמוניה מיוננת (UIA) מתחילה כבר ברמות של 0.05mg/l (שים לב כי מדובר ב UIA ולא ב TAN). ריכוז של 2mg/l יוביל למוות של רב סוגי הדגים.
טיפול בעקת אמוניה
במרבית המקרים, מקור האמוניה הוא במזון הדגים. על מנת לטפל בבעיות אמוניה, בשלב הראשון מומלץ להפחית באופן דרסטי את כמות ותדירות ההאכלה, עד לכדי צום מוחלט. בכל מקרה, בעת עקת אמוניה, הדגים צפויים לאבד תאבון וכך רב האוכל הניתן יגיע לקרקעית האקווריום, שם יוביל יעבור תהליכי ריקבון ויוביל להחמרה נוספת.
הפחתה או עצירת ההאכלה, תיצור הזדמנות עבור החיידקים הניטריפיקנטים להתרבות ולהפעיל את מחזור החנקן בקצב גבוה יותר, דבר אשר עשוי לסייע בהתמודדות עם העקה. החלפה של כ-50% מכמות מי האקווריום או הבריכה במים חדשים, והחלפה זהה ונוספת כעבור כשלושה ימים, יסייעו בהפחתה מידית של רמת האמוניה ולהקלה על מצוקת הדגים.
קיים בשוק מגוון רחב של חומרים הסופחים אליהם אמוניה והופכים אותה לבלתי רעילה עבור הדגים. רובם עובדים על עיקרון של שימוש בפורמאלדהיד (בצרוף או ללא ביסולפיט- ומשם הריח החזק של התכשירים הללו) המגיב עם האמוניה ליצירת מתאן-אמין [3].
חומר נוסף נפוץ בשימוש לספיחת אמוניה, הינו הזאוליט. זהו למעשה מינרל העשוי מאלומיניום-סיליקאט ובעל משיכה (אפיניות) גבוהה לאמוניה [4]. שימוש בחומרים אלה מומלץ רק כאשר בעיית האמוניה חמורה במיוחד ואינם מומלצים לשימוש קבוע.
לסיכום:
השילוב המסוכן שבין רעילותה הגבוהה של אמוניה והיותה בלתי ניתנת לזיהוי (אלא בעזרת ערכות ייעודיות), הופכים אותה לגורם המסוכן ביותר בגידול דגים. כיוון שמרב המקרים להתפרצות עקת אמוניה נובעים מהאכלת יתר, ניקוי קבוע של שאריות רפש בבריכת הנוי או באקווריום ואי הפרזה בהאכלה צפויים למנוע התפרצותה.
בעת בדיקה של ריכוזי האמוניה, עלינו להתחשב בחומציות וטמפרטורת המים, כיוון שיש לשניהם השפעה על חלקה היחסי של האמוניה המיוננת מתוך כלל האמוניה והיא המסוכנת ביותר. במקרה של עקת אמוניה, מומלץ בתחילה להפסיק את מתן המזון לדגים, לבצע שתי החלפות מים בכמות של 50% מנפח המיכל ובמקרים חמורים אף להשתמש בסופח אמוניה מסחרי.
כל שינוי קיצוני בבריכה או באקווריום, אשר יוביל לשינוי ברמת ה pH, הטמפרטורה, החמצון, או באוכלוסיית החיידקים מפרקי החנקן, עשוי להוביל לעליה בריכוזי האמוניה במים, לכן יש להימנע משינויים כאלה עד כמה שניתן.
מקורות מידע:
רוצה להישאר מעודכן?
המוצרים באתר נשלחים בדואר רגיל (10-14 ימי עסקים- עלות של 20 ₪), או בדואר מהיר עד הבית בימי שני ושלישי בלבד (עד 5 ימי עסקים בעלות של 50 ₪יתכנו עיכובים ליישובים מרוחקים ). * הזמנת צמחי מים באתר מתאפשרת בדואר מהיר, או באיסוף בחווה בלבד. * בהזמנה של 400 ש”ח ומעלה של צמחי מים, המשלוח ללא תוספת עלות. * המשלוחים מתבצעים לכל חלקי הארץ – עד לבית הלקוח. * ניתן לבצע איסוף מחוות סנפירים- בתאום מראש. * ט.ל.ח.
© כל הזכויות שמורות לסנפירים חוות גידול דגי נוי
הקמת אתר מכירות ע”י יולי פיתוח וקידום אתרים
